内容
自然科学研究機構生理学研究所の定藤 規弘 教授・菅原 翔 大学院生(総合研究大学院大学)、名古屋工業大学の田中 悟志 テニュア・トラック准教授の研究グループは、東京大学先端科学技術研究センターの渡邊克巳准教授と共同で、運動トレーニングを行った際に他人から褒められると、“上手”に運動技能を取得できることを科学的に証明しました。これまでの本研究グループの研究成果から、他人に褒められると金銭報酬を得たときと同じように脳の線条体が活発に働くことが分かっていました。今回の研究成果は、その脳の働きの結果として、運動技能の習得が、より“上手”に促されることを示したものと言えます。米国科学誌プロスワン(電子版、11月7日号)に掲載されます。
実験では、48人の成人にトレーニングを行い、ある連続的な指の動かし方(30秒間のうちにキーボードのキーをある順番に出来るだけ早く叩く)を覚えてもらいました。そして、この指運動トレーニングをしてもらった直後に、被験者を3つのグループにわけ、“褒められ”実験をしました。ある人は“自分が評価者から褒められる”グループ、別の人は“他人が評価者から褒められるのを見る”グループ、さらに別の人は“自分の成績だけをグラフで見る”グループの3つのグループです。すると、自分が評価者から褒められたグループは、次の日に覚えたことを思いだして再度指を動かしてもらうときに、他のグループに比べて、より“上手”に指運動が出来ることがわかりました。運動トレーニングの直後に褒められることが、その後の運動技能の習得を促したことがわかります。
定藤教授は「“褒められる”ということは、脳にとっては金銭的報酬にも匹敵する社会的報酬であると言えます。運動トレーニングをした後、この社会的報酬を得ることによって、運動技能の取得をより“上手”に促すことを科学的に証明できました。“褒めて伸ばす”という標語に科学的妥当性を提示するもので、教育やリハビリテーションにおいて、より簡便で効果的な“褒め”の方略につながる可能性があります」と話しています。

本研究は文部科学省科学研究費補助金の補助を受けて行われました。
今回の発見
1.運動トレーニングのあと褒められることで、運動技能の取得が、より“上手”に促されることがわかりました。
図1 運動トレーニングを行ったあとの“褒められ”実験の方法
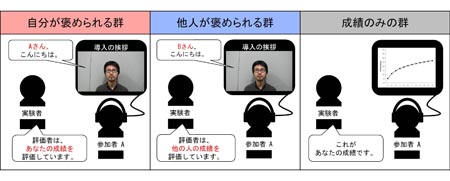
今回の研究では、キーボードをある順番で連続的にたたく指運動トレーニングを行い、その後、被験者を図のような3つのグループにわけて“褒められ”実験を行いました。そして、翌日に、覚えたことを披露してもらうテスト(キーボードをある順番に30秒間に何回たたけるか)を行いました。
図2 自分が褒められると、運動技能の成績が上がる
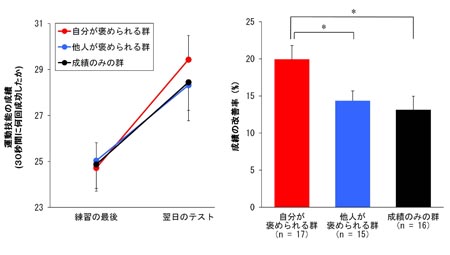
指運動トレーニングで覚えたことを翌日のテストで披露してもらうとき(キーボードをある順番に30秒間に何回たたけるか)、運動トレーニング直後に“自分が褒められた”グループでは、より“上手”に運動技能が取得・記憶出来ていることがわかりました。
この研究の社会的意義
教育やリハビリテーションにおける“褒めて伸ばす”の科学的裏付け
今回の研究成果より、教育やリハビリテーションの現場で、運動トレーニングによる運動技能の習得をより“上手”に促すためには、“褒める”ことが効果的であることがわかりました。“褒められる”ということは、脳にとっては金銭的報酬にも匹敵する社会的報酬であると言えます。運動トレーニングをした後、この社会的報酬を得ることによって、運動技能の記憶・取得をより“上手”に促すものと考えられます。
論文情報
Social rewards enhance the offline improvement in motor skill
Sho K. Sugawara, Satoshi Tanaka, Shuntaro Okazaki, Katsumi Watanabe, Norihiro Sadato
米国科学誌プロスワン(電子版 11月7日号)
お問い合わせ先
<研究について>
自然科学研究機構 生理学研究所 心理生理学部門
教授 定藤 規弘(さだとう のりひろ)
TEL:0564-55-7842 FAX: 0564-55-7843
Email: sadato@nips.ac.jp
菅原 翔 大学院生
TEL:0564-55-7845 FAX: 0564-55-7843
Email: sugashou@nips.ac.jp
国立大学法人 名古屋工業大学 若手研究イノベータ養成センター
テニュア・トラック准教授 田中 悟志
Tel:052-735-7150 Fax:052-735-7150
Email:tanaka.satoshi@nitech.ac.jp
<広報に関すること>
自然科学研究機構 生理学研究所 広報展開推進室
准教授 小泉 周 (こいずみ あまね)
Tel:0564-55-7722 Fax:0564-55-7721
Email:pub-adm@nips.ac.jp
国立大学法人名古屋工業大学
企画広報課 犬飼 伸宏
TEL 052-735-5004 FAX 052-735-5009
e-mail inukai.nobuhiro@nitech.ac.jp