第25回 (2014)生理科学実験技術トレーニングコース
論文引用指数総合で生理学研究所が第4位に(2008~2012年)神経科学分野で第1位に「2015年度大学ランキング」(朝日新聞出版)より引用
朝日新聞出版発行の 「2015年度大学ランキング」(2014年4月発行)で、トムソン・ロイター社による2008-2012年における論文引用度に関するランクが発表され ま した。 研究者人口や注目度の高さや時流などを無視して安易に分野を越えての比較を行うことはできませんが、「総合」で生理学研究所は第4位に、また、「神経科学 分野」でも生理学研究所が第1位にランクされました。
| 大学・機関 | 論文数 | 引用度指数 | |
| 1 | 分子科学研究所 | 1,162 | 138.4 |
| 2 | 国立遺伝学研究所 | 656 | 132.6 |
| 3 | 国立天文台 | 1,674 | 130.8 |
| 4 | 生理学研究所 | 600 | 130.1 |
| 5 | 立教大学 | 707 | 126.4 |
| 6 | 東京大学 | 36,938 | 125.7 |
| 6 | 首都大学東京 | 2,859 | 125.7 |
| 8 | 東京工業大学 | 11,669 | 125.6 |
| 9 | 高エネルギー加速器研究機構 | 2,605 | 124.0 |
| 10 | 京都大学 | 27,234 | 122.6 |
| 11 | 大阪大学 | 21,598 | 122.5 |
| 12 | 奈良先端科学技術大学院大学 | 1,649 | 120.8 |
| 13 | 早稲田大学 | 5,241 | 119.8 |
| 14 | 筑波大学 | 9,293 | 119.7 |
| 14 | 総合研究大学院大学 | 2,069 | 119.7 |
| 大学・機関 | 論文数 | 引用度指数 | |
| 1 | 生理学研究所 | 364 | 134.6 |
| 2 | 藤田保健衛生大学 | 212 | 133.8 |
| 3 | 総合研究大学院大学 | 264 | 128.8 |
| 4 | 自治医科大学 | 103 | 123.0 |
| 5 | 東京大学 | 1,117 | 122.3 |
| 6 | 京都大学 | 938 | 121.5 |
| 7 | 弘前大学 | 118 | 119.9 |
| 8 | 名古屋大学 | 572 | 119.7 |
| 9 | 群馬大学 | 284 | 118.0 |
| 10 | 北海道大学 | 503 | 116.6 |
岡本准教授と和氣准教授が平成26年度科学技術分野の文部科学大臣賞を受賞しました。
内容
文部科学省では、科学技術に関する研究開発、理解増進等において顕著な成果を収めた者について、その功績を讃えることにより、科学技術に携わる者の意欲の向上を図り、もって我が国の科学技術水準の向上に寄与することを目的とする科学技術分野の文部科学大臣表彰を定めております。
この度、生理学研究所の岡本秀彦准教授と和氣弘明准教授が平成26年度若手科学者賞を受賞され、
4月15日(火)に表彰式が行われました。

革新的イノベーション創出プログラム(COI STREAM)に採択されました
内容
生理学研究所では、文部科学省の「革新的イノベーション創出プログラム(COI STREAM)」に採択された、「精神的価値が成長する感性イノベーション拠点」の研究を開始しました。
本拠点プログラムは、中核拠点を担う広島大学とマツダ株式会社を中心に遂行される合同プロジェクトであり、この中で生理学研究所は、㈱NTTデータ経営研究所、静岡大学、浜松ホトグラフ㈱と共にサテライト拠点として、革新的なイノベーションを実現できる研究に取り組むことになります。
本拠点プログラムのテーマは『感性や知覚の可視化技術を確立』であり、この技術をものづくりに生かすことで、心の豊かさを実現できる社会を目指しています。この中で生理学研究所は、井本所長を研究リーダーとして、特に『知覚の可視化技術の確立』に向けた研究を実施しています。
文部科学省「革新的イノベーション創出プログラム」
http://www.mext.go.jp/a_menu/kagaku/coi/index.htm
科学技術振興機構「センターオブイノベーション(COI)プログラム」
http://www.jst.go.jp/coi/index.html
※COIについてのお問い合わせはこちらから
http://www.nips.ac.jp/contents/contact/
※メディアの皆様はこちらから
http://www.nips.ac.jp/contents/media/
第45回 生理研国際シンポジウム
第45回 生理研国際シンポジウム
「Cutting-edge approaches towards the functioning mechanisms of membrane proteins」
(11/25-11/28まで)
詳しくはこちらをご覧ください。
電位依存性K+チャネルKv4の性質は副サブユニットの付く数によって変わる
概要
イオンチャネル等の膜機能タンパク質には、副サブユニットと複合体を作って機能するものが多くある。電位依存性K+チャネルの一つ、Kv4チャネルは神経細胞、心筋に発現し、細胞の興奮性を調節している。K+ Channel Interacting Protein(KChIP)はKv4チャネルの電流を大きくし、不活性化を遅くし、不活性化からの回復を速くするということが知られているが、詳細な調節機構は未だ不明である。これまで、結晶構造解析によって、Kv4/KChIP複合体は各々のサブユニットが4:4の量体数比(ストイキオメトリー)で結合していることが知られていたが、4:4以外の複合体が存在するのか、また存在する場合、イオンチャネル複合体の機能がどのように変化するのかについては不明であった。今回、我々はまず、Xenopus卵母細胞に打ち込むKv4.2とKChIP4 RNAの量を変化させ、両者の相対的な発現量を調節し、二本刺膜電位固定法を用いてイオンチャネル複合体の性質を電気生理学的に解析した。その結果、KChIP4の発現量依存的にKv4.2の性質が変化するという知見を得た。ここで見られた変化が、KChIP4の結合数によるものであるという可能性を検討するため、Kv4.2とKChIP4のストイキオメトリーを4:2あるいは4:4に固定するタンデムコンストラクト(各々KChIP4-Kv4.2-Kv4.2, KChIP4-Kv4.2)を作成した。両者の電気生理学的性質を比較したところ、4:4チャネルは4:2チャネルよりも速い不活性化からの回復を示し、Kv4チャネルの性質がKChIP4の結合数により調節を受けることが分かった。さらに、monomeric enhanced GFP を付加したKChIP4 (KChIP4-mEGFP)をKv4.2と共発現させ、一分子蛍光イメージング法を用いて、一つのKv4.2チャネルに結合するKChIP4の数を測定した。両サブユニットの相対的な発現量を変化させたところ、KChIP4の発現量が増加するにしたがって、Kv4.2に結合する数が増加し、最大で4つまで結合可能であることが明らかとなった。以上の結果から、Kv4/KChIPイオンチャネル複合体のストイキオメトリーは一定ではなく、両サブユニットの相対的な発現量に依存して変化すること、また、ストイキオメトリーの変化がイオンチャネルの性質に影響を与えることが分かった。
論文情報
Masahiro Kitazawa, Yoshihiro Kubo and Koichi Nakajo
The Stoichiometry and Biophysical Properties of the Kv4 Potassium Channel Complex with KChIP Subunits are Variable Depending on the Relative Expression Level
Journal of Biological Chemistry, published May 8, 2014 as doi:10.1074/jbc.M114.563452
図
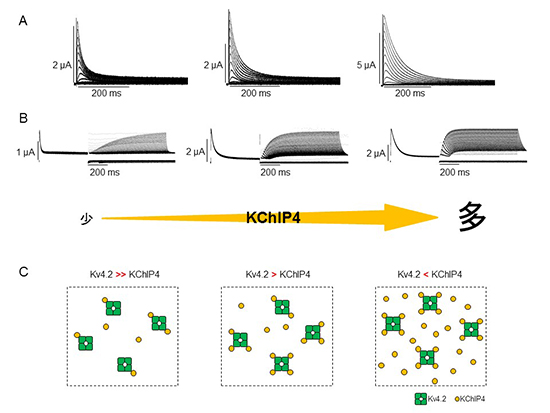
KChIP4の相対的な発現量が増加するにしたがって、Kv4.2の性質が徐々に変化する様子が捉えられた(電流量の増大、不活性化過程の減速(A)、不活性化からの回復過程の加速(B))。また、KChIP4の発現量が増加するにしたがって、一つのKv4.2チャネルに結合するKChIP4の数が増えることから、Kv4.2/KChIP4イオンチャネル複合体のストイキオメトリーは固定されておらず、両者の相対的な発現量依存的に柔軟に変化することがわかった(C)。
ATP受容体チャネルP2X2三量体の活性化時の活性化シグナルの分子内の流れ
概要
我々は、これまでに、ATP 受容体チャネルP2X2が、細胞外ATPの結合と膜電位の変化を複合的に感知し活性化する受容体チャネルであることを明らかにしてきた。その活性化の機構、特に、二つの情報が分子内をどのように流れ、どのように集約されるのかは、未解決である。また、P2X2は3量体であるが、2分子のATPの結合によって活性化されることが知られている。そのため、2分子のATPの結合による活性化シグナルが3量体中をどのように流れるかは興味ある課題である。
この問題にアプローチするためには、3量体中に、数と位置を規定して変異を導入することが必要である。そこで、Uracil Specific Excision Reagentを用いるUSER法により、ATP結合部位のK308A変異、リンカー領域のD315A変異、膜貫通部位のT339S変異を、数をコントロールして導入したtandem trimeric construct (TTC) を高効率に作成し、電気生理学的解析を行った。(1) ATP結合能を失う変異K308Aを、1, 2, 3 個導入したTCCを用いた実験により、ATPによる活性化にも膜電位依存的活性化にも、2個のATP 結合部位が必要かつ充分であることが明らかになった。(2) ATP 結合部位とチャネルポアの存在する膜貫通部位をつなぐリンカー領域に位置するD315にD315A変異を導入すると、[ATP]- 応答関係に膜電位依存性の異なる2コンポーネントが出現することを見出した。このD315A変異を、1, 2, 3 個導入したTCCを用いた実験においても、K308Aの場合と同様、1個の変異では際だった変化がみられず、2個の変異により著しい変化が見られた。(3) 膜貫通部位のポア最狭部に位置するT339にT339S変異を導入すると、膜電位依存性を失ってどの電位でも活性化するようになる。このT339Sを、1, 2, 3個導入したTCCを用いた実験においては、K308A, D315Aの場合と異なり、膜電位依存的活性化が、導入した変異の数により段階的に変化することが明らかになった。これらの結果は、ATP結合部位、リンカー部位では、2個の正常なサブユニットの存在が必要十分であるのに対し、膜貫通部位では、3個のサブユニットが同等にかつ段階的に寄与することを示す。
ATP結合による活性化シグナルの分子内の流れにさらにアプローチするために、同一サブユニット(cis)、もしくは隣接サブユニット(trans) の2つのレベルに、それぞれの変異を1つずつ導入したTCCコンストラクトを作成し、性質の比較解析を行った。その結果、(4) K308AとD315Aの場合は、cis位置に導入したものと trans 位置に導入したもので機能が異なること、cis 位置に導入したものの性質は野生型に類似していること、また、 (5) K308AとT339Sの場合、および、D315AとT339Sの場合は、cis位置に導入したものと trans位置に導入したもので機能が類似していることを見いだした。
以上の結果から、3量体に対する2分子のATPの結合情報が、リンカー部位まではATPが結合した2個のサブユニット上をそのまま流れ、膜貫通部位において3つのサブユニットに均等に拡散することが示された。
論文情報
Batu Keceli and Yoshihiro Kubo
Signal transmission within the P2X2 trimeric receptor
Journal of General Physiology (2014) 143: 761-782
(Published online May 26 2014, 10.1085/jgp.201411166)
図 3量体ATP受容体P2X2の分子内のシグナルの伝達
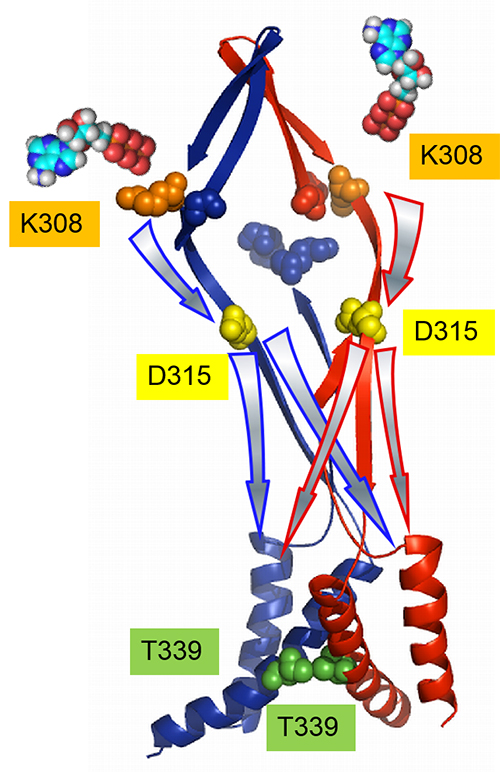 3つのサブユニットを連結したコンカテマーに、変異の位置と数をコントロールして導入することにより、2分子のATPの結合による活性化シグナルの流れを解析した。 ATPの結合のシグナル(K308) は、結合した2つのサブユニット上を、結合部位とチャネルポアをつなぐリンカー部位 (D315) まで流れる。その後、拡散し、チャネルポア部位 (T339) では、3つのサブユニットに均等に伝達される。
3つのサブユニットを連結したコンカテマーに、変異の位置と数をコントロールして導入することにより、2分子のATPの結合による活性化シグナルの流れを解析した。 ATPの結合のシグナル(K308) は、結合した2つのサブユニット上を、結合部位とチャネルポアをつなぐリンカー部位 (D315) まで流れる。その後、拡散し、チャネルポア部位 (T339) では、3つのサブユニットに均等に伝達される。
第25回(2014年) 生理科学実験技術トレーニングコース 募集開始
毎年恒例の生理研・実験技術トレーニングコース参加申込を受け付けています。
受付期間は、5/26(月)12:00~6/27(金)12:00 までです。
申し込みは以下のHPよりお願いいたします。
http://www.nips.ac.jp/training/2014/
第三回 自然科学研究機構若手研究者賞を、中條 浩一 助教(生理学研究所・神経機能素子研究部門)が受賞
自然科学研究機構では、新しい自然科学分野の創成に熱心に取り組み成果をあげた優秀な若手研究者を対象として「自然科学研究機構若手研究者賞」を授与しています。
今回、第三回の若手研究者賞を、生理学研究所・神経機能素子研究部門の中條浩一助教が受賞しました。
授賞式と記念講演が6月15日に日本科学未来館7階未来館ホールにて行われます。
授賞式・記念講演会
タイトル:「宇宙・生命・脳・物質・エネルギー」若手研究者による Rising Sun Ⅲ
―自然科学研究機構若手研究者賞記念講演―
日時:2014年6月15日(日)13:00~17:20
(ミート・ザ・レクチャラーズ 17:25~18:10)
会場:日本科学未来館 7階 未来館ホール
詳しくはこちらをご覧ください。
http://www.nins.jp/public_information/03risingsun.php
2014年度 第2回 生理学研究所 大学院説明会 (8月2日) の参加登録開始
2014年度 第2回 生理学研究所 大学院説明会 (8月2日) の参加登録開始
詳しくはこちらから。
サルが手を動かしている時に生じる体性感覚ニューロン活動パターンの推定
概要
脊髄損傷や脳梗塞の患者さんの生活の質を高める医療技術として、脳活動から直接義手などの機器外部を操作するブレイン・マシーン・インターフェイス(BMI)の研究が進み、患者さんが実際にBMIを用いて義手を動かすことができる時代になってきました。一方で、脊髄損傷や脳梗塞の患者さんの多くは、四肢の運動麻痺だけでなく、体性感覚(身体の位置や何を触ったか)麻痺を併発することがしばしばみられ、動かした義手の体性感覚を患者さんの脳に直接戻すことは次の課題となっています。外部機器を動かすBMI研究の歴史的な経緯として、大脳皮質運動野の活動を手指の位置・運動情報に変換するアルゴリズムが発表され、大きく研究が進んできました。そこで、本研究では、麻痺した体性感覚を再建するために、手指の位置・運動情報から末梢神経群の活動パターンに変換するアルゴリズムの確立を目的として研究を行いました。
手や腕に受容野をもつ末梢神経の活動を記録するために、2頭のサルの頚髄6番目から8番目の後根神経節(DRG)に剣山電極を埋め込みました。サルが上肢の到達把持運動を行っているときの複数の末梢神経の活動を同時記録したところ、2頭のサルから、それぞれ16,13個の末梢神経の神経活動を記録することに成功しました(図1)。さらに、末梢神経群活動記録と同時に、上肢の運動軌跡も記録しました(図1)。はじめに、スパース線形回帰分析を用いて、複数の末梢神経群活動から上肢の運動軌跡を推定することに成功しました。このことは、末梢神経が自発運動における上肢の運動情報を正確にコードしている事を示唆しています。次に、スパース線形回帰分析と神経発火モデル(integrate and fire model)を用いて、上肢の運動情報から末梢神経の発火頻度を推定し、そこからさらに発火パターンを高精度に推定することにも成功しました(図2)。今回作製した運動情報から神経活動パターンを推定する変換アルゴリズムは、体性感覚代替する為のインターフェースをデザインするにあたって有用です。将来的には、このアルゴリズムを使って導き出された活動パターンで末梢神経の活動を誘発することで、人工的な体性感覚を引き起こせ、脳梗塞や脊髄損傷患者に対して、失った体制感覚機能(身体の触覚や位置)を再獲得できる可能性があります(図3)。
論文情報
Umeda, T., Watanabe, H., Sato, MA., Kawato M., Isa T., Nishimura, Y.
“Decoding of the spike timing of primary afferents during voluntary arm movements in monkeys”
Front. Neurosci. 8: e97, 2014
http://journal.frontiersin.org/Journal/10.3389/fnins.2014.00097/full
図1 到達把持運動しているサルのDRGから記録している模式図と、記録された末梢神経群活動と肩関節角度
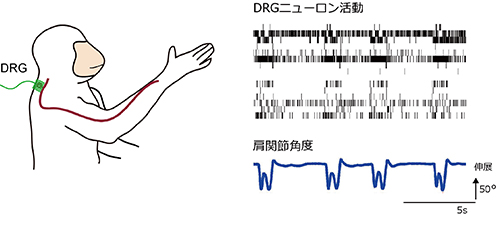 サルが到達把持運動をしているときに、16個の末梢神経が関節角度変化に対応して、それぞれの発火パターンで発火しています。
サルが到達把持運動をしているときに、16個の末梢神経が関節角度変化に対応して、それぞれの発火パターンで発火しています。
図2:発火パターンの推定モデルと運動情報から推定した末梢神経群の活動(発火頻度と発火パターン)
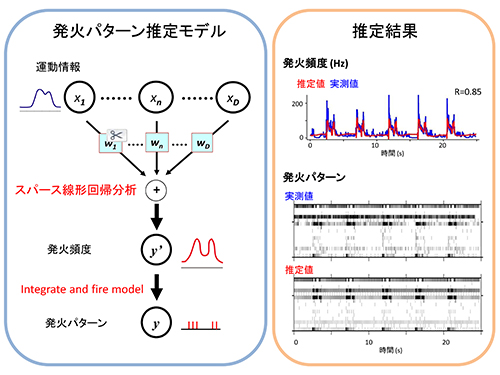 左:まず、スパース線形解析を用いて肩・肘・手首関節角度情報から末梢神経の発火頻度を計算、次に、神経発火モデル(integrate and fire model)を用いて発火頻度から発火パターンを計算しました。右上:一つの末梢神経の発火頻度の推定例。実測した発火頻度(青)と運動情報から推定した発火頻度(赤)間の相関係数(R)は0.85。右下:16個の末梢神経の実測した発火パターンと推定した発火パターン。
左:まず、スパース線形解析を用いて肩・肘・手首関節角度情報から末梢神経の発火頻度を計算、次に、神経発火モデル(integrate and fire model)を用いて発火頻度から発火パターンを計算しました。右上:一つの末梢神経の発火頻度の推定例。実測した発火頻度(青)と運動情報から推定した発火頻度(赤)間の相関係数(R)は0.85。右下:16個の末梢神経の実測した発火パターンと推定した発火パターン。図3:体性感覚機能を保持したBMIの模式図
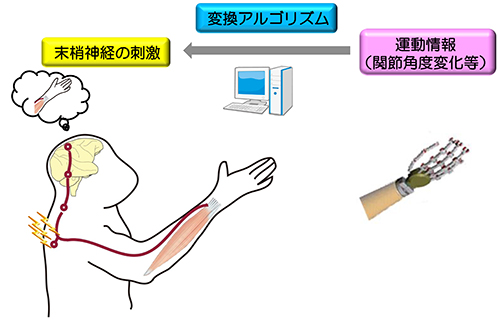 体性感覚機能を脳にフィードバックする一つの方法として、外部機器の運動情報から導き出した発火パターンで末梢神経を活動してあげることで、人工的な運動感覚を誘発することを想定しています。
体性感覚機能を脳にフィードバックする一つの方法として、外部機器の運動情報から導き出した発火パターンで末梢神経を活動してあげることで、人工的な運動感覚を誘発することを想定しています。
心臓ポンプ機能を支えるイオンチャネルKCNQ1/KCNE1の「遅い」開閉を制御する分子メカニズム
内容
| 心臓をポンプとして動かすためには細胞の電気活動が必須であり、その電気活動はイオンチャネルと呼ばれる膜タンパク質が担っています。イオンチャネルには複数の種類があり、それぞれのタイミングで開閉することで心臓を規則正しく収縮させています。その中の一つKCNQ1は、KCNE1と呼ばれる膜タンパク質とともに働くことで、他のイオンチャネルと比べ非常にゆっくりと開閉することが知られています。このイオンチャネルの機能が損なわれると不整脈などの疾患を引き起こすことから、この開きにくく閉じにくい性質がヒトの心臓機能には不可欠です。今回、自然科学研究機構生理学研究所の中條浩一助教らは、このKCNQ1/KCNE1チャネルの持つ開きにくく閉じにくい性質が、KCNQ1上に存在する二つのフェニルアラニン残基によってもたらされていることを発見しました。フェニルアラニン残基は比較的大きなアミノ酸であり、二つのフェニルアラニン残基が互いに干渉し、KCNQ1/KCNE1チャネルを開きにくくすることがわかりました。本研究結果により、KCNQ1/KCNE1チャネルの動作原理の理解が深まることで、QT延長症候群などの心疾患に対する薬剤開発にも貢献すると期待されます。本研究はNature Communications(6月12日電子版)に掲載されます。 |
KCNQ1は膜電位依存性カリウムチャネルの一種であり、心臓ではKCNE1と呼ばれる膜タンパク質とイオンチャネル (KCNQ1/KCNE1チャネル)を形成して、心臓の「遅い」カリウム電流を担っています。KCNQ1、KCNE1どちらの遺伝子が損なわれてしまってもQT延長症候群などの心疾患を引き起こすことから、この「遅い」イオンチャネルがヒトの心臓の電気的活動に必要不可欠です(図1)。この「遅い」性質を作りだすために、これまでKCNE1の結合がKCNQ1チャネルを開きにくくしていることはわかっていましたが、その分子機構の理解は十分ではありませんでした。
一般的にイオンチャネルは膜電位センサーと考えられる4番目の膜貫通領域(S4セグメント)が細胞外に向かって動くことが引き金となり、イオンを透過するためのゲートが開きます(図2)。今回、研究グループは、アフリカツメガエル卵母細胞をヒトKCNQ1およびヒトKCNE1遺伝子の発現系として用いて実験を行い、KCNQ1のS4セグメント上の232番目のフェニルアラニン残基(Phe232)が、KCNQ1チャネルの活性化時にポアドメイン(カリウムイオンを透過する部位)に存在する別のフェニルアラニン残基(Phe279)とぶつかることで、KCNQ1チャネルを開きにくくしていることを見出しました(図3)。フェニルアラニンは20種類のアミノ酸の中でも比較的大きい側鎖を持つアミノ酸であり、今回発見したフェニルアラニン残基を他のさまざまな大きさのアミノ酸残基に置換したところ、側鎖の大きさとKCNQ1チャネルの開きやすさに相関関係があることがわかりました(図3)。
さらに電位センサー上部に取り付けた蛍光の強度変化によって電位センサードメインの動きを直接測定したところ、KCNQ1/KCNE1チャネルにおいては、電位センサードメインの動きとイオンチャネル活性(電流)の間に大きな遅延があり、この遅延はこれらのフェニルアラニン残基が原因であることも見出しました(図4)。
以上の結果から、これら2つのフェニルアラニン残基がKCNQ1/KCNE1チャネルを開きにくくする分子メカニズムであると結論付けました(図5)。
中條助教は、「今回の研究により、KCNQ1/KCNE1チャネルが開きにくくなる分子メカニズムを明らかにすることができました。今回の知見をもとに、このチャネルの開きやすさを調節するような不整脈治療薬の開発に役立つ可能性があります。」と話しています。

本研究は文部科学省科学研究費補助金の補助を受けて行われました。
今回の発見
1. KCNQ1の2つのフェニルアラニン残基(Phe232, Phe279)が、KCNQ1/KCNE1チャネルが開く際にぶつかることがわかりました。
2. Phe232, Phe279それぞれにおいて、アミノ酸側鎖が大きいほどKCNQ1/KCNE1チャネルが開きにくくなることがわかりました。
3. Phe232, Phe279の存在により電位センサードメインの動きと電流の間の遅延が生じ、これがKCNQ1/KCNE1チャネルを開きにくくしている分子メカニズムであると考えられました。
図1 心臓ではさまざまなタイミングでイオンチャネルが開閉し活動電位を制御する
 心臓では複数種類のイオンチャネルがさまざまなタイミングで開閉して心臓の活動電位を制御しています。その中でも、KCNQ1/KCNE1チャネルによるIKs電流は活動電位の比較的遅いタイミングで流れます。遺伝子の異常などによりIKs電流がなくなってしまうと、活動電位の延長が起き(赤い点線)、QT延長症候群などの不整脈の原因になります。
心臓では複数種類のイオンチャネルがさまざまなタイミングで開閉して心臓の活動電位を制御しています。その中でも、KCNQ1/KCNE1チャネルによるIKs電流は活動電位の比較的遅いタイミングで流れます。遺伝子の異常などによりIKs電流がなくなってしまうと、活動電位の延長が起き(赤い点線)、QT延長症候群などの不整脈の原因になります。
図2 KCNQ1/KCNE1チャネルは遅く開閉するイオンチャネル
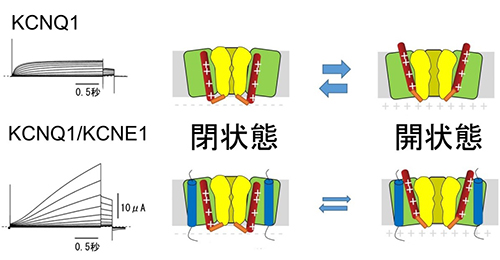 一般に膜電位依存性イオンチャネルにおいては、細胞内の電位が+に転じること(脱分極)によって、正電荷を持つ4番目の膜貫通領域(S4、図中赤い棒)が細胞外に向かって動き、イオンを透過するためのゲートが開きます。KCNE1が結合することにより、KCNQ1チャネルの開閉速度は遅くなり、開きにくい性質に変わります。
一般に膜電位依存性イオンチャネルにおいては、細胞内の電位が+に転じること(脱分極)によって、正電荷を持つ4番目の膜貫通領域(S4、図中赤い棒)が細胞外に向かって動き、イオンを透過するためのゲートが開きます。KCNE1が結合することにより、KCNQ1チャネルの開閉速度は遅くなり、開きにくい性質に変わります。
図3 KCNQ1/KCNE1チャネルの開きやすさはPhe232とPhe279のアミノ酸側鎖の大きさに依存する
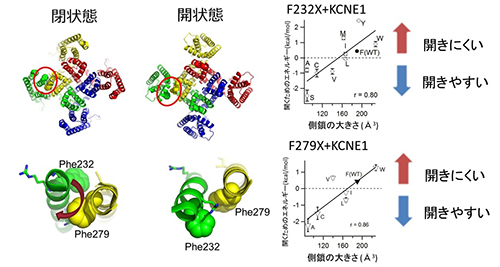 KCNQ1/KCNE1チャネルにおいて、Phe232(F232)とPhe279(F279)をさまざまなアミノ酸に変異させると、アミノ酸側鎖が大きいほど、開くために高い電位が必要になります。
KCNQ1/KCNE1チャネルにおいて、Phe232(F232)とPhe279(F279)をさまざまなアミノ酸に変異させると、アミノ酸側鎖が大きいほど、開くために高い電位が必要になります。
図4 電位センサードメインの動きと電流の間の遅延はPhe232とPhe279によって起こる
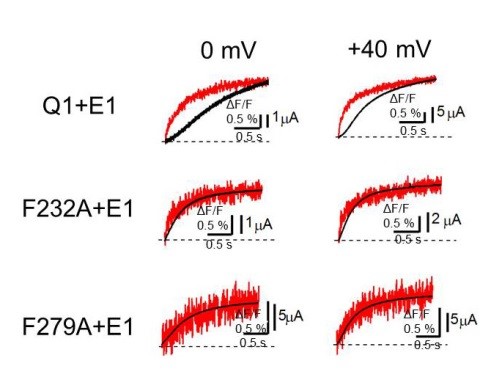 電位センサードメインの動きを示す蛍光強度 (赤)と電流(黒)を同時測定すると、KCNQ1/KCNE1チャネル(Q1+E1)では電位センサーが動いたあと電流が流れるまでに遅延が生じますが、Phe232あるいはPhe279を小さいアラニン残基に変異させると(F232A/F279A)、その遅延がほぼ見られなくなります。
電位センサードメインの動きを示す蛍光強度 (赤)と電流(黒)を同時測定すると、KCNQ1/KCNE1チャネル(Q1+E1)では電位センサーが動いたあと電流が流れるまでに遅延が生じますが、Phe232あるいはPhe279を小さいアラニン残基に変異させると(F232A/F279A)、その遅延がほぼ見られなくなります。
図5 Phe232とPhe279がぶつかることでKCNQ1/KCNE1チャネルが開きにくくなる
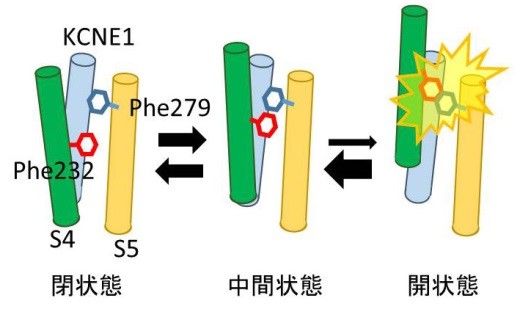 KCNQ1/KCNE1チャネルが閉状態から中間状態を経て開状態に至る際、4番目の膜貫通領域(S4)上のPhe232と5番目の膜貫通領域(S5)上のPhe279がぶつかることで、開状態が不安定化してチャネルが開きにくくなっていると考えられます。
KCNQ1/KCNE1チャネルが閉状態から中間状態を経て開状態に至る際、4番目の膜貫通領域(S4)上のPhe232と5番目の膜貫通領域(S5)上のPhe279がぶつかることで、開状態が不安定化してチャネルが開きにくくなっていると考えられます。
この研究の社会的意義
KCNQ1チャネルの活性化調節機構をターゲットとした新しい不整脈治療薬の開発
KCNQ1、KCNE1ともにQT延長症候群などの不整脈の原因遺伝子です。このイオンチャネル複合体の構造と機能を明らかにすることは、不整脈等の心疾患治療薬を開発する上でも重要です。今回発見はKCNQ1/KCNE1チャネルの動作原理、特に開閉のタイミングについてのメカニズムについての理解を深めるとともに、この知見をもとにした、チャネルの活性を調節するような薬剤あるいは治療法の開発が期待されます。
論文情報
Steric hindrance between S4 and S5 of the KCNQ1/KCNE1 channel hampers pore opening.
Koichi Nakajo and Yoshihiro Kubo.
Nature Communications 5:4100 doi: 10.1038/ncomms5100 (2014).
お問い合わせ先
<研究について>
自然科学研究機構 生理学研究所 神経機能素子研究部門
助教 中條 浩一 (なかじょう こういち)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
TEL:0564-55-7722、FAX:0564-55-7721
EMAIL:pub-adm@nips.ac.jp
第3回若手研究者賞 授賞式が行われました
内容

生理学研究所神経機能素子部門の中條浩一助教が、第3回若手研究者賞を受賞されました。若手研究者賞は、新しい自然科学分野の創成に熱心に取り組み成果をあげた優秀な若手研究者を対象として、自然科学研究機構が授与しています。本年度は、6月15日(日)にお台場の日本科学未来館 にて授賞式典が開催され、選ばれた5名の研究者による記念講演と、参加者と研究者が語り合うミート・ザ・レクチャラーズが行われました。会場 では、高校生を始めとした多数の来場者と共に、活発で熱い意見交換が行われました。


大学院講義 第8回「視床下部による寿命制御」の日程変更についてのお知らせ
日程が変更になりました。
第8回 生理科学専門科目
演題:「視床下部による寿命制御」
日時: 7月4日(金曜日)午前10:00-12:00
場所:生理学研究所(明大寺地区 1階)講義室
講師:箕越 靖彦(生理研、生殖・内分泌系発達機構)
南部篤教授がTVに出演されます
TV出演のお知らせです。
生体システム研究部門の南部篤教授がNHK「ためしてガッテン」に出演されます。
『ためしてガッテン』
「やる気低下が危険信号 脳の異変を発見せよ」
6月25日(水)20時~20時43分(総合テレビ)
7月 2日(水)16時5分~16時48分(総合テレビ・再放送)
http://www9.nhk.or.jp/gatten/schedule/
皆様 ご覧ください。
自分の動作が真似をされたことを気づくために重要な脳部位の活動は、自閉症スペクトラム障害者で減少していることを解明
内容
| 自閉症スペクトラム障害(ASD)者は、自分の動作が真似をされたことに気づくのが苦手と言われています。しかし脳のどのような働きが原因で、真似をされたことに気づくのが苦手であるのかはよく分かっていません。今回、生理学研究所の定藤規弘教授、福井大学小坂浩隆特命准教授、金沢大学棟居俊夫特任教授らの研究グループは、機能的磁気共鳴画像法(fMRI)を用いて、自分の動作が相手に真似をされたときの脳活動を測定しました。その結果、他者の真似に気づくことに関わる脳部位の活動が、健常者に対しASD者で減少していることが分かりました。この脳部位の活動低下は、「なぜASD者は真似をされたことに気づきにくいのか」という謎を明らかにする一助になります。 |
<研究の背景>
自閉症スペクトラム障害(Autism spectrum disorder: ASD)は発達障害の一つで、その障害者は対人コミュニケーションを苦手とします。この障害を改善する方法として、他者の真似をし、真似されたことを理解する訓練が知られています。これまでの多くの研究は、「他者の真似をする」ときの脳の働きがASD者と健常者(定型発達者)でどのように異なるのかについて明らかにしてきました。しかしその一方で、「自分の真似をされている」ときの脳の働きが自閉症スペクトラム障害でどのように変容しているのかについては分かっていませんでした。本研究では機能的磁気共鳴画像法(fMRI)を用いて、他者から真似をされたときの脳の働きをASD群と健常群で比較しました。
<研究の内容>
目で見た情報を専ら処理する脳部位を視覚野と呼びます。視覚野の中には、観察した身体の部位に対して強く反応する領域があります。この領域はExtrastriate Body Area (EBA、イービーエー)と呼ばれています。近年の研究でEBAは真似をされているときに活動が高まることが知られています。
知的障害を有さないASD群19名(平均年齢25歳)と、年齢と知能指数を一致させた健常群22名が、本研究に参加しました。参加者は自分で動作(図1)を行ったあと、他者の動作を観察しました。他者の動作は自分の動作と同じ場合と異なる場合があります。つまり他者の動作と自分の動作が同じ場合は「真似をされて」おり、異なる場合は「真似をされていない」ことになります。機能的磁気共鳴画像法(fMRI)を用いて健常群の脳活動を調べてみると、真似をされたときのほうが真似をされていないときに比べて、EBAの活動が高くなりました(図2左図の青色部分)。これとは対照的にASD群のEBAではこのような活動は観察されず、健常群とASD群の間に活動差があることが分かりました(図2左図の緑色部分)。この結果はASD群のEBAが真似をされたときにうまく働いていないことを示しています。
本研究は、文部科学省「脳科学研究戦略推進プログラム」並びに、文部科学省科学研究費補助金の一環として行われました。


<用語>
・自閉症スペクトラム障害(ASD)
「精神障害の診断と統計マニュアル」(DSM)の第5版において、ASDは、下記の2つの特徴で定義されます。自閉症スペクトラム障害は、注意欠陥多動性障害などとともに「発達障害」として分類されます。
| ①「社会的コミュニケーションおよび社会的相互作用の障害」 視線が合わない、独り遊びが多い、友人関係が作れない、 他者の表情や気持ちが理解できない、他者への共感が乏しい、 言葉の発達に遅れがある、会話が続かない、冗談や嫌味が通じない、など。 ②「限定した興味と反復行動ならびに感覚異常」 興味範囲が狭い、特殊な才能をもつことがある、 意味のない習慣に執着、環境変化に順応できない、 常同的で反復的な言語の使用、常同的で反復的な奇異な運動、 感覚刺激への過敏または鈍麻、限定された感覚への探究心、など。 |
・機能的磁気共鳴法(fMRI)
ある脳部位の神経細胞の活動に伴い、近傍の血管において酸素を持つヘモグロビン(赤血球のタンパク質)と酸素を持たないヘモグロビンの相対量が変化します。fMRIは核磁気共鳴現象を用いてこの変化を信号 (BOLD信号) 値として測定する手法です。
今回の発見
1. 真似をされていること対して反応する脳部位(EBA)の活動は、健常者に比べて自閉症スペクトラム障害(ASD)者で減少していることを明らかにしました。
2. EBAの活動がASDによって減少することは、なぜASD者が真似をされていることに気づくのが苦手であるのかを説明する手がかりになります。
図1 実験に用いた動作
 脳活動を測定している状態で実験参加者は、上図にある動作うち1つを行い、その直後に他者が行う動作を観察しました。他者の動作は自分の動作と同じ場合(真似をされる条件)と異なる場合(真似をされない条件)があります。
脳活動を測定している状態で実験参加者は、上図にある動作うち1つを行い、その直後に他者が行う動作を観察しました。他者の動作は自分の動作と同じ場合(真似をされる条件)と異なる場合(真似をされない条件)があります。
図2 真似をされたときのEBAの活動が自閉症スペクトラム障害(ASD)者で減少する
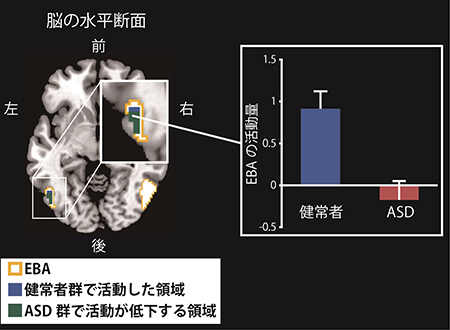 左図は、真似をされていないときに比べて真似をされたときに強く活動した領域を示しています。健常群ではEBA(黄色枠)の一部が活動しましたが(脳断面の青色の部分)、ASD群では活動が低下していました(脳断面の緑色の部分)。右図は、その領域の活動量を棒グラフで表しています。青色の健常群と赤色のASD群で、EBA領域の活動量に差があることが分かりました。
左図は、真似をされていないときに比べて真似をされたときに強く活動した領域を示しています。健常群ではEBA(黄色枠)の一部が活動しましたが(脳断面の青色の部分)、ASD群では活動が低下していました(脳断面の緑色の部分)。右図は、その領域の活動量を棒グラフで表しています。青色の健常群と赤色のASD群で、EBA領域の活動量に差があることが分かりました。
この研究の社会的意義
ASDの病態解明と介入の効果判定に使えるバイオマーカーの確立につながる研究
本研究は世界で初めて、真似をされた際の脳活動がASDで減少することが示唆されました。近年、ASDの障害を軽減させるための行動的介入の研究が進められており、真似を活用した訓練が有用であることが示されています。本研究は、ASDの病態解明に重要な知見を与えただけでなく、行動的介入の効果を判定するのに活用できると考えられます。
論文情報
Attenuation of the contingency detection effect in the extrastriate body area in Autism Spectrum Disorder
Yuko Okamoto; Ryo Kitada; Hiroki C Tanabe; Masamichi J Hayashi; Takanori Kochiyama; Toshio Munesue; Makoto Ishitobi; Daisuke N Saito; Hisakazu T Yanaka; Masao Omori; Yuji Wada; Hidehiko Okazawa; Akihiro T Sasaki; Tomoyo Morita; Shoji Itakura; Hirotaka Kosaka; Norihiro Sadato
お問い合わせ
<研究について>
自然科学研究機構 生理学研究所 心理生理学研究部門
教授 定藤 規弘 (さだとう のりひろ)
Tel: 0564-55-7841 FAX: 0564-55-7783
email: sadato@nips.ac.jp
福井大学 子どものこころの発達研究センター
特命准教授 小坂 浩隆 (こさか ひろたか)
Tel: 0776-61-8363 (精神医学教室) FAX: 0776-61-8136
email: hirotaka@u-fukui.ac.jp
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
TEL: 0564-55-7722、FAX: 0564-55-7721
email: pub-adm@nips.ac.jp
生理学研究所 紹介ビデオが完成しました!
2月末より撮影を行って参りました生理研紹介ビデオと各部門ごとの紹介ビデオが、このたび完成致しました。
HP上へ各映像をアップしましたのでお知らせします。
☆ 日本語版PV
(HP内、せいりけん広場 → ドットチャンネル内)
http://www.nips.ac.jp/nipsquare/dotchannel/
☆ 研究部門紹介
(HP内、研究部門紹介ページの部門横にリンクがあります)
http://www.nips.ac.jp/research/section/
☆ 井本所長インタビュー
(HP内、所長からのmessage ページ下部にあります)
http://www.nips.ac.jp/profile/message/
※各映像は全てYoutubeにアップしておりますのでYoutube内の研究力強化戦略室のページからもアクセス出来ます。
☆ Youtube 生理学研究所 研究力強化戦略室のページ
https://www.youtube.com/channel/UCpKiGBsyt39O6YInMoCDoBQ
ご覧ください。
第25回(2014年)生理科学実験技術トレーニングコース終了しました
7月28日(月)から8月1日(金)にわたって開催された「第25回(2014年)生理科学実験技術トレーニングコース」は、全国の若手研究者(大学院生、学部学生も含む)116名の参加を得て、無事終了することができました。参加の皆様、ありがとうございました。
総合研究大学院大学 生理科学専攻 博士論文発表会
標記の会を下記の通り各日程で開催します。奮ってご参加下さい。
記
8月8日(金)
■(課程博士)WEI, Fei (魏 飛)
13:00~ 生理学研究所(山手地区)3号館2階大会議室
『 The Chinese herb, Danshen (Radix Salviae Miltiorrhizae), induces salivary fluid secretion 』
8月25日(月)
■(課程博士)髙木 一代
10:00~ 生理学研究所(明大寺地区)1階セミナー室A,B
『 Role of uncoupling protein 1 and muscle AMP-activated protein kinase in diet-induced thermogenesis 』
■(課程博士)田淵 紗和子
15:00~ 生理学研究所(明大寺地区)1階セミナー室A,B
『 The role of orexin neurons in the regulation of sleep and wakefulness 』
8月29日(金)
■(課程博士)SUN,Wuping (孫 武平)
15:00~ 生理学研究所(明大寺地区)1階セミナー室A,B
『 Involvement of TRPV2 in the differentiation of mouse brown adipocytes 』
※各発表終了後は審査に入る為、ご退席願います。
国際研究協力課大学院係
歩行中枢と腕の筋肉とをコンピュータで人工的に繋いで歩行の随意制御に成功
内容
| 脳からの信号を四肢に伝える経路である脊髄を損傷すると、損傷領域以外の脳や下肢に問題が無くても歩行障害が生じます。この歩行障害の改善には損傷した脊髄を繋ぎなおす必要がありますが、これまで実現できませんでした。今回、自然科学研究機構生理学研究所の西村幸男准教授を中心とした、笹田周作研究員(現所属:相模女子大学)、福島県立医科大学の宇川義一教授、及び千葉大学の小宮山伴与志教授らの研究グループは脳から上肢の筋肉へ伝えられる信号をコンピュータで読み取り、その信号に合わせて腰髄を非侵襲的に磁気刺激することにより、脊髄の一部を迂回して人工的に脳と腰髄にある歩行中枢をつなぐことで下肢の歩行運動パターンを随意的に制御することに世界で初めて成功しました。本研究結果は、The Journal of Neuroscience誌(2014年8月13日号オンライン)に掲載されます。 |
ヒトが歩くときの脚の運動リズムや左右肢の交代的な運動パターンは片方の脚の複数の筋肉が複雑に協調して、更にそれが左右脚で連携して活動することによって出来上がっています。この複雑な筋活動は腰髄に存在する下肢歩行中枢によって生み出されており、私たちが歩くときは脳から下肢歩行中枢への指令によって歩行運動パターンが制御されていると考えられています。研究グループは、脊髄損傷による歩行障害の多くは脳と下肢歩行中枢との繋がりが切れたことが問題であって、脳も腰髄にある下肢歩行中枢もその機能を失っているわけではないということに着目しました。そこで、脳活動の情報が内在している生体信号をコンピュータで読み取り、下肢歩行中枢へ伝えることで、脳と下肢歩行中枢を人工的に接続することが出来れば、脊髄の一部を迂回して下肢の歩行運動パターンを随意的に制御できると考えました(図1)。
研究グループは神経や四肢に障害のない健常人を対象に、脳活動の情報が内在している電気的信号を手や腕の筋肉から記録しました。それをコンピュータで読み取り、その信号に合わせた刺激パルスをリアルタイムで下肢歩行中枢の存在する腰髄へ、非侵襲的に磁気刺激することによって、コンピュータによる脊髄迂回路を形成し、脳と下肢歩行中枢を人工的に神経接続しました(図2)。
神経や四肢に障害のない健常人にコンピュータによる脊髄迂回路を適用したところ、被験者が下肢をリラックスしている状態であっても、コンピュータによる脊髄迂回路によって下肢の歩行運動パターンを意図的に誘発し、止めることが可能でした(図3)。さらに、その歩行サイクルを速くしたりゆっくりしたりと、随意的に歩行の運動パターンを制御可能であることがわかりました。この結果は脳から上肢筋へ伝えられる信号が脊髄の一部を迂回して腰髄にある歩行中枢へ伝えられたことを意味します。
西村准教授は「この技術により、脊髄損傷の患者自身の損傷されずに残った機能を利用して、手術なしで随意的な歩行を再建できる可能性を示すことができたと考えています。しかしながら、現段階では脚が障害物にぶつかった際の回避運動や立位姿勢の保持は制御できないのが大きな課題です。今後は、慎重に安全性を確認しながら、臨床応用に向けて研究開発を進めて行きます。」と話しています。
本研究は JST 戦略的創造研究推進事業 個人型研究(さきがけ)の「脳情報の解読と制御」研究領域(研究総括:川人 光男 (株) 国際電気通信基礎技術研究所 脳情報通信総合研究所 所長)における研究課題「人工神経接続によるブレインコンピューターインターフェイス」(研究者:西村 幸男)及び文部科学省科学研究費補助金の一環として行われました。
今回の発見
1.健常被験者にて、コンピュータを介した脊髄の迂回路によって、自分の意思で下肢の歩行運動パターンを制御することに成功した。
2.脊髄損傷患者への随意歩行再建の可能性を示した。
図1 コンピュータによる脊髄迂回路の概念図
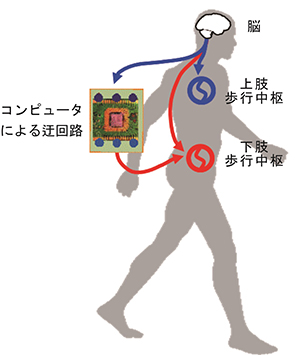
ヒトの歩行運動は脊髄にある歩行中枢によって運動のリズムやパターンが作られ、この下肢歩行中枢は脳から脊髄を経由して伝えられる下行性指令によって駆動、制御されていると考えられています。従って脳から随意的に制御できる信号をコンピュータで読み取り、下肢歩行中枢へ伝えることで、その取り付けられたコンピュータが人工的な神経経路として機能し、脊髄の一部を迂回して下肢の歩行運動を随意的に制御できると考えられます。本研究では、脊髄の信号ではなく手や腕の筋肉の電気的信号を利用する事で、脳から下肢歩行中枢への迂回路を作製することを目指しました。
図2 コンピュータによる脊髄迂回路の内容
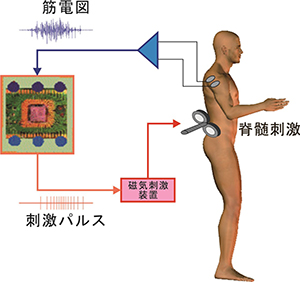
コンピュータによる脊髄迂回路は、脳から上肢筋への信号を筋電図として読み取る記録部(青色)、記録された信号を処理して刺激パルスに作り変える制御部(橙色)、及び生成された刺激パルスを皮膚表面に当てる磁気コイルで刺激を行う刺激部(赤色)で構成されます。記録及び刺激は非侵襲性で、腰髄へ磁気刺激することにより下肢の歩行中枢を制御しました。
図3 コンピュータを介した脊髄迂回路による下肢歩行運動パターンの制御
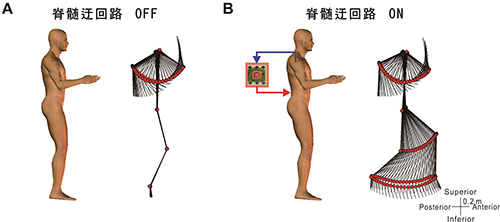
図3Aは被験者が上肢の腕振り運動中にコンピュータによる脊髄迂回路をオフした場合を表しています。被験者が腕振り運動をしていてもリラックスしている下肢には何も運動は出現しません。図3Bはコンピュータによる脊髄迂回路をオンにして、上肢の腕振り運動を被験者が意図的に行い、その筋電位信号によって磁気刺激を制御した場合です。被験者には下肢をリラックスするように伝えていますが、コンピュータによる脊髄迂回路によって、腕の運動に合わせて下肢の歩行運動が生じます。この結果はコンピュータによる脊髄迂回路によって下肢の歩行運動パターンを意図的に制御できることを意味しています。
この研究の社会的意義
電極を埋め込まない方法で、脊髄損傷患者の随意歩行を再建できる可能性を示した。
論文情報
Volitional walking via upper limb muscle-controlled stimulation of the lumbar locomotor center in man.
S. SASADA, K. KATO, S. KADOWAKI, S. GROISS, Y. UGAWA, T. KOMIYAMA and Y. NISHIMURA.
The Journal of Neuroscience. 2014年 8月13日オンライン掲載
お問い合わせ先
<研究について>
自然科学研究機構 生理学研究所 認知行動発達機構研究部門
准教授 西村幸男(ニシムラユキオ)
Tel: 0564-55-7766 FAX: 0564-55-7766
email: yukio@nips.ac.jp
<JSTの事業に関すること>
科学技術振興機構 戦略研究推進部
TEL:03-3512-3525 、FAX:03-3222-2066
email:presto@jst.go.jp
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
TEL: 0564-55-7722、FAX: 0564-55-7721
email: pub-adm@nips.ac.jp
科学技術振興機構 広報課
TEL: 03-5214-8404、FAX:03-5214-8432
email:jstkoho@jst.go.jp