グリア細胞注1は神経細胞とともに脳の大部分を占める細胞ですが、神経細胞と異なり不活性であるとされ、脳内情報の担い手とは捉えられてきませんでした。また、これまでグリア細胞だけを特異的に刺激する方法がなかったため、その役割も十分に調べられてきませんでした。今回の研究では、マウスにおいてグリア細胞の活動を光で操作する技術(光遺伝学注2)を新たに開発し、脳でのグリア細胞の新規の役割を明らかにしました。
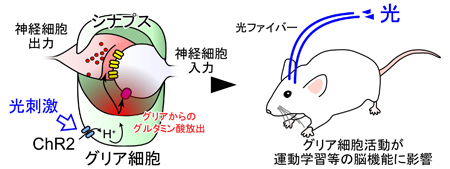
光で活性化するチャネルロドプシン注3という物質によってグリア細胞のみを活性化したところ、グリア細胞から興奮性の伝達物質であるグルタミン酸が放出され、このグルタミン酸が神経細胞間のシナプス伝達注4に影響を与え、動物の運動学習機能が促進されるなどの効果を明らかにしました(図1)。
さらに、グリア細胞がグルタミン酸を放出する仕組みも新規に発見しました。神経細胞は、刺激によって細胞内部のカルシウム濃度が上がると、細胞内に存在するグルタミン酸の詰まった小胞から細胞外へグルタミン酸を放出します。ところがグリア細胞は、細胞の膜上に存在するチャネル注5を開いて、細胞内のグルタミン酸を放出します。このチャネルは細胞内が酸性になると開くので、グリア細胞内が酸性になるとグルタミン酸を放出することになります。
グリア細胞の酸性化は、脳梗塞などの脳虚血注6時に起こります。これまでに、脳虚血時には脳内が酸性になり、大量のグルタミン酸が放出され、その興奮性神経毒性により脳細胞死に至ることが知られていました。しかし、どこから大量のグルタミン酸が放出されるのか、また、どんな仕組みで放出されるのか、不明のままでした。本研究は、この疑問に答え、脳内の酸性化がグリア細胞内で特に速く進行すること、そして、その酸性化そのものがグリア細胞のグルタミン酸放出を促していることを示しました。さらに、光に反応して細胞内をアルカリ化するアーキオロドプシン注7という物質を、同じグリア細胞に発現させ、脳虚血が起こっている最中に光によって細胞をアルカリ化したところ、グルタミン酸放出が抑制され、脳虚血に伴う脳組織の破壊を食い止めることができました(図2)。
本研究グループによって明らかにされたように、グリア細胞は学習等の脳機能を調整しており、その過剰な活動は脳組織を破壊する結果を引き起こします。本研究の知見は、今後、学習における脳機能の亢進や、脳梗塞などの病態時におけるダメージコントロールにもつながると期待されます。
![matsui-press20141.23-1.jpg]() チャネルロドプシン2(ChR2)をグリア細胞に発現させ、これを光で刺激すると、グリア細胞内が酸性化することが明らかになった。この酸性化が引き金となって、細胞質内の陰イオンであるグルタミン酸が、細胞を囲む膜に存在する陰イオンチャネルを介して細胞外へと放出されることが分かった。このようにして、グリア細胞の活動は神経細胞に伝わり、最終的には学習等の脳機能に影響することが示唆された(本研究およびSasaki,…,Matsui*, PNAS, 2012 参照)。
チャネルロドプシン2(ChR2)をグリア細胞に発現させ、これを光で刺激すると、グリア細胞内が酸性化することが明らかになった。この酸性化が引き金となって、細胞質内の陰イオンであるグルタミン酸が、細胞を囲む膜に存在する陰イオンチャネルを介して細胞外へと放出されることが分かった。このようにして、グリア細胞の活動は神経細胞に伝わり、最終的には学習等の脳機能に影響することが示唆された(本研究およびSasaki,…,Matsui*, PNAS, 2012 参照)。
図2 脳虚血によるグリア細胞内酸性化とグルタミン酸放出の間の因果関係。
![matsui-press20141.23-2.jpg]() A, 脳虚血時には、血管(上丸)からの酸素とグルコースの供給が止まり、グリア細胞のグリコーゲンが分解され、乳酸が蓄積することで細胞内が酸性化する。この酸性化がグリア細胞からの過剰なグルタミン酸放出につながると考えられる。B, 脳虚血によって生じるグリア細胞内の酸性化は、グリア細胞に発現させたアーキオロドプシン(ArchT)の光刺激によって、拮抗させることができる。このとき、グリア細胞からのグルタミン酸放出が抑制され、過興奮による神経細胞死を防ぐことができた。
A, 脳虚血時には、血管(上丸)からの酸素とグルコースの供給が止まり、グリア細胞のグリコーゲンが分解され、乳酸が蓄積することで細胞内が酸性化する。この酸性化がグリア細胞からの過剰なグルタミン酸放出につながると考えられる。B, 脳虚血によって生じるグリア細胞内の酸性化は、グリア細胞に発現させたアーキオロドプシン(ArchT)の光刺激によって、拮抗させることができる。このとき、グリア細胞からのグルタミン酸放出が抑制され、過興奮による神経細胞死を防ぐことができた。
図3 細胞内pHの光遺伝学操作により虚血時におけるグリア細胞の役割を探る。
![matsui-press20141.23-3.jpg]() A, チャネルロドプシン2(ChR2)は、主に水素イオンを通すので、細胞内を酸性化する働きがある。細胞内pHイメージングによって酸性化を確認した。B, アーキオロドプシン(ArchT)は、逆に、水素イオンを細胞外に汲み出す光作動性のポンプである。細胞内pHはアルカリ化することが確認された。C, 小脳スライス標本を浸す灌流液から酸素とグルコースを抜く(OGD)と、グリア細胞内が急速に酸性化する。神経細胞(プルキニエ細胞)から電気記録を取ると、OGDとともに興奮性内向き電流が流れる。D, グリア細胞に発現させたArchTを光刺激してグリア細胞内の酸性化を拮抗させると、興奮性内向き電流が大幅に抑制された。グルタミン酸受容体阻害剤による効果とほぼ同じであることから、ArchT光刺激によってグリア細胞からのグルタミン酸放出が止まったと考えられる。
A, チャネルロドプシン2(ChR2)は、主に水素イオンを通すので、細胞内を酸性化する働きがある。細胞内pHイメージングによって酸性化を確認した。B, アーキオロドプシン(ArchT)は、逆に、水素イオンを細胞外に汲み出す光作動性のポンプである。細胞内pHはアルカリ化することが確認された。C, 小脳スライス標本を浸す灌流液から酸素とグルコースを抜く(OGD)と、グリア細胞内が急速に酸性化する。神経細胞(プルキニエ細胞)から電気記録を取ると、OGDとともに興奮性内向き電流が流れる。D, グリア細胞に発現させたArchTを光刺激してグリア細胞内の酸性化を拮抗させると、興奮性内向き電流が大幅に抑制された。グルタミン酸受容体阻害剤による効果とほぼ同じであることから、ArchT光刺激によってグリア細胞からのグルタミン酸放出が止まったと考えられる。
図4 グリア細胞のアルカリ化で梗塞領域の拡大を抑制。
![matsui-press20141.23-4.jpg]() A, Rose bengal法により人工的に脳梗塞を作った。B, 3時間の局所的脳梗塞で大規模な構造的ダメージが観察されたが、その期間中、グリア細胞に発現させたArchTを間欠的に光刺激し続けた群においては、障害を抑制することができた。
A, Rose bengal法により人工的に脳梗塞を作った。B, 3時間の局所的脳梗塞で大規模な構造的ダメージが観察されたが、その期間中、グリア細胞に発現させたArchTを間欠的に光刺激し続けた群においては、障害を抑制することができた。
【用語解説】
注1.グリア細胞:神経系を構成する神経細胞以外の細胞の総称。アストロサイト、オリゴデンドロサイト、マイクログリアなどがある。本研究でのグリア細胞はアストロサイトを指す。
注2.光遺伝学(オプトジェネティクス):藻や古細菌等に発現する光感受性のタンパク質(注3と7を参照)を、哺乳類のマウスやラットの特定の脳細胞に発現させて、その細胞の活動を光で自在に操作する技術。
注3.チャネルロドプシン:光によって作動する、水素イオンを通すタンパク質。チャネルロドプシンを持つ細胞に光を当てると細胞を興奮させることができる。また、細胞内を酸性化することもできる。
注4.シナプス伝達:神経細胞間における化学物質(伝達物質)を介した情報の伝達。
注5.チャネル:細胞の膜上に存在する細胞内外で小さな分子を通過させるタンパク質。細胞に小さな孔を開けることで、物質を移動させる。
注6.脳虚血:脳への血流が滞り、脳組織へ酸素とグルコース等の栄養が行き届かなくなった状態。
注7.アーキオロドプシン:光によって作動する、水素イオンを細胞外に汲み出すタンパク質。アーキオロドプシンを持つ細胞に光を当てると細胞内をアルカリ化することができる。
【光遺伝学についての補足説明】
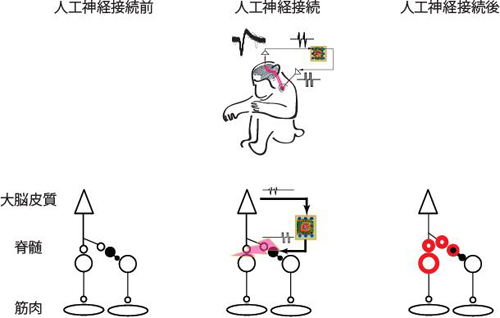
この技術は8年ほど前に開発され、瞬く間に全世界の研究者が利用するに至りました。特定の種類の神経細胞が脳の機能や心の働きにどう影響するのか、ダイレクトに因果関係を調べることができる画期的な技術であるからです。
本研究者は、この技術をグリア細胞に適用するという、他の研究者がほとんど試みなかったことに挑戦しました(図3)。また、本研究者は、細胞を興奮させるのに使うチャネルロドプシン2は水素イオンを通すので、光をあてると細胞内が酸性化することも見出しました。一方、光を当てると細胞の内から外へ水素イオンを汲み出す機能を持つアーキオロドプシンを使うと、細胞内がアルカリ化することも分かりました。この二つは細胞内のpHを操作するツールとしても使えることが分かりました。これによって、グリア細胞内酸性化がグルタミン酸の放出の直接の引き金になっていることを発見しました。細胞機能に影響するシグナルとしては、カルシウムイオンや膜電位ばかりが注目されてきましたが、細胞内pHというものが、もうひとつの重要なシグナルであるということが、この研究の新たな発見です。光遺伝学の応用分野が、脳科学に留まらず、もっと広く他の医学・生物学研究にも広げられる可能性も示唆されました。
【脳虚血についての補足説明】
血流が滞る原因としては、脳の血管が詰まるような脳梗塞、心停止、大量出血などがあります。脳虚血時には、脳組織が酸性化することや、どこからか大量のグルタミン酸が出てくることは、これまでにも知られていました。大量のグルタミン酸は興奮性神経毒性を生み、脳細胞死へと至る不可逆的な過程を引き起こしてしまいます。本研究では、従来は平行して起こる二つの現象と考えられてきた、酸性化とグルタミン酸放出の間に、因果関係があることを見出しました。グリア細胞内の酸性化こそが、脳虚血時におけるグルタミン酸放出を引き起こしているのです。この見解のもと、グリアの酸性化を拮抗させるような光遺伝学的操作を施してみたところ、虚血性脳障害を緩和することができました(図4)。
もちろん、予め、ヒトの脳にアーキオロドプシン等のタンパク質を発現させておき、虚血に伴う酸性化を食い止めるといった介入をすることはできませんので、この研究結果をそのまま脳梗塞などの治療に使えるわけではありません。しかし、グリア細胞のpHを安定化させることが一番の鍵であることが分かりました。細胞内pHを緩衝させる治療法や、細胞内水素イオンを細胞外へと汲み出す生来の仕組みを賦活化させる薬剤の開発など、いくつかの応用可能性を示しています。
【論文題目】
Optogenetic countering of glial acidosis suppresses glial glutamate release and ischemic brain damage
「光遺伝学的手法でグリア細胞の酸性化を抑えれば、グリアからのグルタミン酸放出と虚血性脳障害が抑制される」
Kaoru Beppu, Takuya Sasaki , Kenji F. Tanaka, Akihiro Yamanaka, Yugo Fukazawa, Ryuichi Shigemoto & Ko Matsui
別府 薫、佐々木 拓哉、田中 謙二、山中 章弘、深澤 有吾、重本 隆一、松井 広
掲載雑誌: Neuron (January 22, 2014 掲載予定)
【他の参考論文】
Sasaki T, Beppu K, Tanaka KF, Fukazawa Y, Shigemoto R, Matsui K* (2012)
Application of an optogenetic byway for perturbing neuronal activity via glial photostimulation.
Proc Natl Acad Sci U S A, 109: 20720–20725. (* corresponding author )
この論文は、グリア活動を光操作することで、グリアからグルタミン酸が放出され、神経細胞に影響を与え、学習等の脳機能を促進することがあることを示した初めての論文。
お問い合わせ先
<研究について>
東北大学大学院医学系研究科
脳神経科学コアセンター・新医学領域創生分野
准教授 松井 広(まつい こう)
電話番号: 022-717-8208
ファックス:022-717-8594
Eメール:matsui@med.tohoku.ac.jp
<報道担当>
東北大学大学院医学系研究科・医学部広報室
稲田 仁(いなだ ひとし)
電話番号: 022-717-7891
ファックス: 022-717-8187
Eメール:hinada@med.tohoku.ac.jp
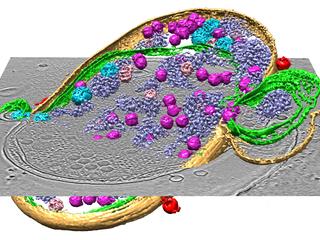 急速凍結法により氷に閉じ込められたシアノバクテリアについて、位相差電子顕微鏡より内部のウイルスを含めたシアノバクテリアの微細立体構造が明らかとなった。(ベイラー医科大のホームページより)
急速凍結法により氷に閉じ込められたシアノバクテリアについて、位相差電子顕微鏡より内部のウイルスを含めたシアノバクテリアの微細立体構造が明らかとなった。(ベイラー医科大のホームページより)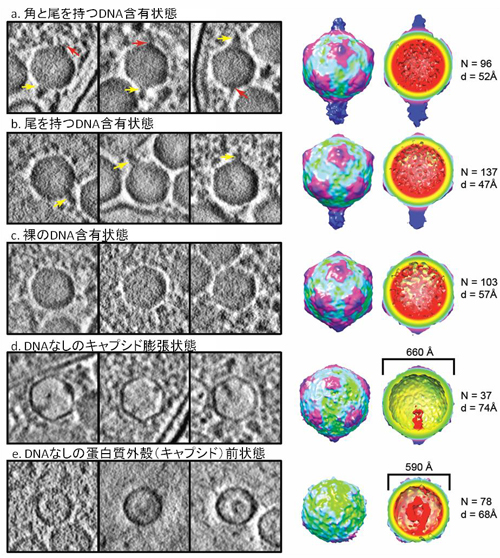

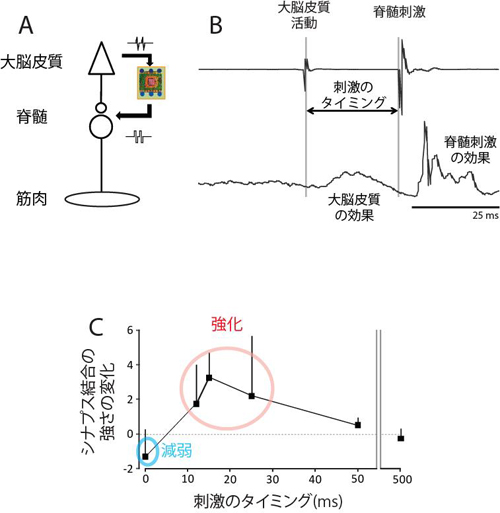

 自己抗体は文字通り自己の蛋白質に対して反応し、細胞、組織、臓器に障害を引き起こします。今回、研究グループは脳神経細胞の蛋白質に対する既知の自己抗体(黒字の蛋白質に対する抗体)に加えて、さまざまな蛋白質に対する新規の自己抗体(赤字の蛋白質に対する抗体)を発見しました。
自己抗体は文字通り自己の蛋白質に対して反応し、細胞、組織、臓器に障害を引き起こします。今回、研究グループは脳神経細胞の蛋白質に対する既知の自己抗体(黒字の蛋白質に対する抗体)に加えて、さまざまな蛋白質に対する新規の自己抗体(赤字の蛋白質に対する抗体)を発見しました。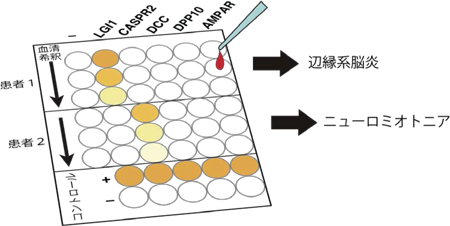 今回、多数の新規自己抗体の標的抗原を同定したことにより、一人の患者血清中にどのタイプの抗体がどの程度存在しているかを簡便、高感度、かつ特異的に測定することが可能となりました。
今回、多数の新規自己抗体の標的抗原を同定したことにより、一人の患者血清中にどのタイプの抗体がどの程度存在しているかを簡便、高感度、かつ特異的に測定することが可能となりました。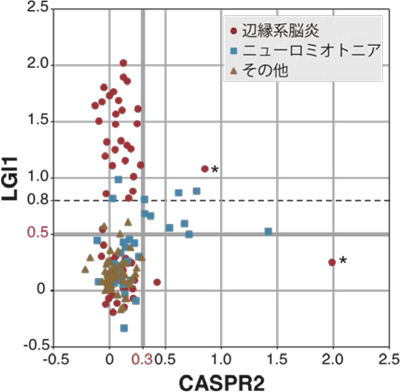 LGI1抗体価(縦軸)とCASPR2抗体価(横軸)と疾患との関連性を示しています。LGI1抗体価が0.8以上の患者さんは殆ど例外なく辺縁系脳炎と診断されていたことが明らかになりました(左上の赤色の群)。一方、CASPR2抗体価が0.3以上の患者さんはニューロミオトニア(神経筋緊張病)のケースが有意に多いことが分かりました(右中央の青色の群)。
LGI1抗体価(縦軸)とCASPR2抗体価(横軸)と疾患との関連性を示しています。LGI1抗体価が0.8以上の患者さんは殆ど例外なく辺縁系脳炎と診断されていたことが明らかになりました(左上の赤色の群)。一方、CASPR2抗体価が0.3以上の患者さんはニューロミオトニア(神経筋緊張病)のケースが有意に多いことが分かりました(右中央の青色の群)。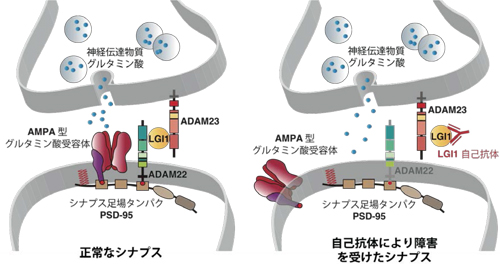 通常、LGI1はシナプス間隙でADAM22、ADAM23と結合し、AMPA型グルタミン酸受容体を精緻にコントロールしています。一方、LGI1の機能が自己抗体により後天的に阻害されると、シナプスにおけるAMPA型グルタミン酸受容体機能が低下し無秩序なシナプス伝達が生じます。その結果、痙攣発作を伴うてんかん病態や記憶障害が生じると考えられます。
通常、LGI1はシナプス間隙でADAM22、ADAM23と結合し、AMPA型グルタミン酸受容体を精緻にコントロールしています。一方、LGI1の機能が自己抗体により後天的に阻害されると、シナプスにおけるAMPA型グルタミン酸受容体機能が低下し無秩序なシナプス伝達が生じます。その結果、痙攣発作を伴うてんかん病態や記憶障害が生じると考えられます。


 チャネルロドプシン2(ChR2)をグリア細胞に発現させ、これを光で刺激すると、グリア細胞内が酸性化することが明らかになった。この酸性化が引き金となって、細胞質内の陰イオンであるグルタミン酸が、細胞を囲む膜に存在する陰イオンチャネルを介して細胞外へと放出されることが分かった。このようにして、グリア細胞の活動は神経細胞に伝わり、最終的には学習等の脳機能に影響することが示唆された(本研究およびSasaki,…,Matsui*, PNAS, 2012 参照)。
チャネルロドプシン2(ChR2)をグリア細胞に発現させ、これを光で刺激すると、グリア細胞内が酸性化することが明らかになった。この酸性化が引き金となって、細胞質内の陰イオンであるグルタミン酸が、細胞を囲む膜に存在する陰イオンチャネルを介して細胞外へと放出されることが分かった。このようにして、グリア細胞の活動は神経細胞に伝わり、最終的には学習等の脳機能に影響することが示唆された(本研究およびSasaki,…,Matsui*, PNAS, 2012 参照)。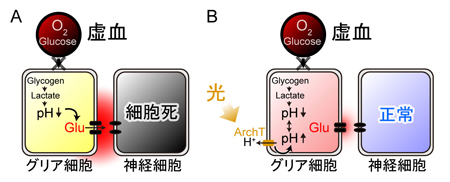 A, 脳虚血時には、血管(上丸)からの酸素とグルコースの供給が止まり、グリア細胞のグリコーゲンが分解され、乳酸が蓄積することで細胞内が酸性化する。この酸性化がグリア細胞からの過剰なグルタミン酸放出につながると考えられる。B, 脳虚血によって生じるグリア細胞内の酸性化は、グリア細胞に発現させたアーキオロドプシン(ArchT)の光刺激によって、拮抗させることができる。このとき、グリア細胞からのグルタミン酸放出が抑制され、過興奮による神経細胞死を防ぐことができた。
A, 脳虚血時には、血管(上丸)からの酸素とグルコースの供給が止まり、グリア細胞のグリコーゲンが分解され、乳酸が蓄積することで細胞内が酸性化する。この酸性化がグリア細胞からの過剰なグルタミン酸放出につながると考えられる。B, 脳虚血によって生じるグリア細胞内の酸性化は、グリア細胞に発現させたアーキオロドプシン(ArchT)の光刺激によって、拮抗させることができる。このとき、グリア細胞からのグルタミン酸放出が抑制され、過興奮による神経細胞死を防ぐことができた。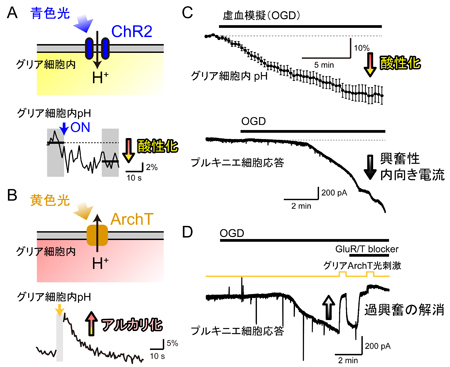 A, チャネルロドプシン2(ChR2)は、主に水素イオンを通すので、細胞内を酸性化する働きがある。細胞内pHイメージングによって酸性化を確認した。B, アーキオロドプシン(ArchT)は、逆に、水素イオンを細胞外に汲み出す光作動性のポンプである。細胞内pHはアルカリ化することが確認された。C, 小脳スライス標本を浸す灌流液から酸素とグルコースを抜く(OGD)と、グリア細胞内が急速に酸性化する。神経細胞(プルキニエ細胞)から電気記録を取ると、OGDとともに興奮性内向き電流が流れる。D, グリア細胞に発現させたArchTを光刺激してグリア細胞内の酸性化を拮抗させると、興奮性内向き電流が大幅に抑制された。グルタミン酸受容体阻害剤による効果とほぼ同じであることから、ArchT光刺激によってグリア細胞からのグルタミン酸放出が止まったと考えられる。
A, チャネルロドプシン2(ChR2)は、主に水素イオンを通すので、細胞内を酸性化する働きがある。細胞内pHイメージングによって酸性化を確認した。B, アーキオロドプシン(ArchT)は、逆に、水素イオンを細胞外に汲み出す光作動性のポンプである。細胞内pHはアルカリ化することが確認された。C, 小脳スライス標本を浸す灌流液から酸素とグルコースを抜く(OGD)と、グリア細胞内が急速に酸性化する。神経細胞(プルキニエ細胞)から電気記録を取ると、OGDとともに興奮性内向き電流が流れる。D, グリア細胞に発現させたArchTを光刺激してグリア細胞内の酸性化を拮抗させると、興奮性内向き電流が大幅に抑制された。グルタミン酸受容体阻害剤による効果とほぼ同じであることから、ArchT光刺激によってグリア細胞からのグルタミン酸放出が止まったと考えられる。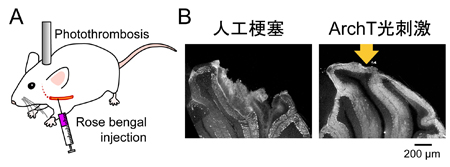 A, Rose bengal法により人工的に脳梗塞を作った。B, 3時間の局所的脳梗塞で大規模な構造的ダメージが観察されたが、その期間中、グリア細胞に発現させたArchTを間欠的に光刺激し続けた群においては、障害を抑制することができた。
A, Rose bengal法により人工的に脳梗塞を作った。B, 3時間の局所的脳梗塞で大規模な構造的ダメージが観察されたが、その期間中、グリア細胞に発現させたArchTを間欠的に光刺激し続けた群においては、障害を抑制することができた。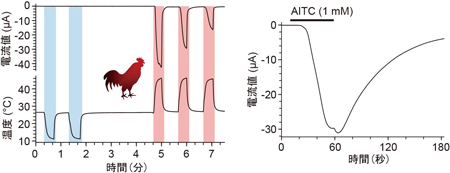 マウスのTRPA1は低温に反応すると報告されていますが、ニワトリTRPA1は低温刺激には反応せず、高温刺激を与えた場合にのみ明瞭な電流応答が生じました。また、ワサビの辛み成分であるアリルイソチオシアネート(AITC)にも反応しました。ニワトリではTRPA1は高温と刺激性化学物質のセンサーとして機能することを示しています。
マウスのTRPA1は低温に反応すると報告されていますが、ニワトリTRPA1は低温刺激には反応せず、高温刺激を与えた場合にのみ明瞭な電流応答が生じました。また、ワサビの辛み成分であるアリルイソチオシアネート(AITC)にも反応しました。ニワトリではTRPA1は高温と刺激性化学物質のセンサーとして機能することを示しています。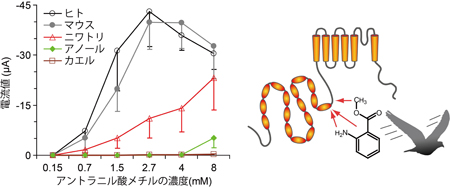 アントラニル酸メチルに対するTRPA1の活性を5種の脊椎動物種間で比較したところ、ニワトリ、マウス、ヒトのTRPA1では明瞭な反応が観察されるのに対して、ニシツメガエルとグリーンアノールトカゲのTRPA1では反応が小さかった。また、ニワトリTRPA1のアントラニル酸メチルによる活性化には互いに近接した3つのアミノ酸が重要な役割を担うことが分かった。
アントラニル酸メチルに対するTRPA1の活性を5種の脊椎動物種間で比較したところ、ニワトリ、マウス、ヒトのTRPA1では明瞭な反応が観察されるのに対して、ニシツメガエルとグリーンアノールトカゲのTRPA1では反応が小さかった。また、ニワトリTRPA1のアントラニル酸メチルによる活性化には互いに近接した3つのアミノ酸が重要な役割を担うことが分かった。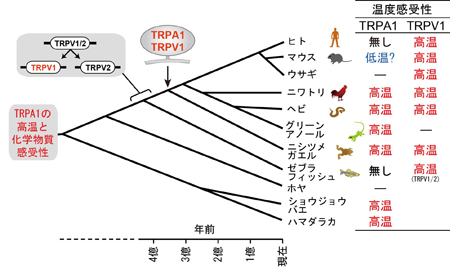 高温センサーであるニワトリのTRPA1は、同じ恒温動物である哺乳類とは特性が異なり、むしろ、変温動物である両生類や爬虫類のTRPA1と類似していました。脊椎動物はもう一つの高温センサーとしてTRPV1を維持しているために、動物種によってはTRPA1の温度感受性が変化したと考えられます。一方、体にダメージを与え得る刺激を感じる能力はどの動物種にも必須であるため、いずれの動物種もTRPA1の化学物質感受性を維持してきたと考えられます。
高温センサーであるニワトリのTRPA1は、同じ恒温動物である哺乳類とは特性が異なり、むしろ、変温動物である両生類や爬虫類のTRPA1と類似していました。脊椎動物はもう一つの高温センサーとしてTRPV1を維持しているために、動物種によってはTRPA1の温度感受性が変化したと考えられます。一方、体にダメージを与え得る刺激を感じる能力はどの動物種にも必須であるため、いずれの動物種もTRPA1の化学物質感受性を維持してきたと考えられます。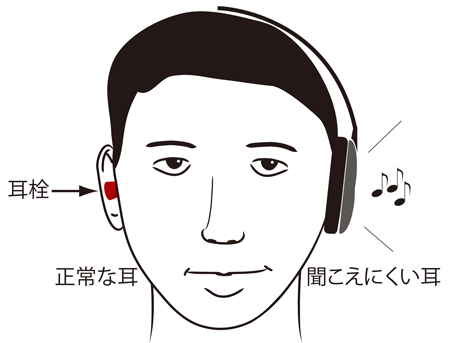 突発性難聴の患者さんの正常な耳には耳栓をします。耳栓は入院中ずっとしてもらいます。そして聞こえにくい方の耳で入院中毎日6時間ヘッドホンから音楽を聞いてもらいます。
突発性難聴の患者さんの正常な耳には耳栓をします。耳栓は入院中ずっとしてもらいます。そして聞こえにくい方の耳で入院中毎日6時間ヘッドホンから音楽を聞いてもらいます。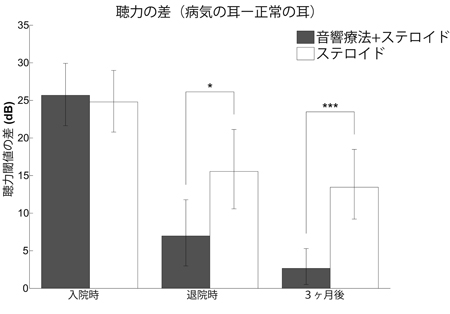 突発性難聴発症後の聴力を比較した。通常行われるステロイド療法にリハビリテーション療法を加えた患者群(灰色の棒グラフ)の方が、ステロイド療法単独の患者群(白色の棒グラフ)よりも聴力の回復が良かった(この図では棒グラフの値が0に近づくほど聴力が回復していることを示しています)。
突発性難聴発症後の聴力を比較した。通常行われるステロイド療法にリハビリテーション療法を加えた患者群(灰色の棒グラフ)の方が、ステロイド療法単独の患者群(白色の棒グラフ)よりも聴力の回復が良かった(この図では棒グラフの値が0に近づくほど聴力が回復していることを示しています)。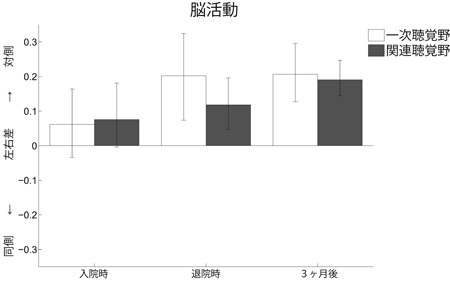 リハビリテーション療法(音響療法)を行った患者に片耳から音を聞かせた時の脳活動を調べました。聴力低下の無い健常者では対側の脳の神経活動がやや大きいのですが(左右差=約0.2)、突発性難聴発症時には脳神経活動にあまり左右差を認めませんでした。しかしながら、ステロイド+音響療法を行うと発症後約3ヶ月で、聴力低下の無い健常者の脳活動の左右差とほぼ同等になりました。
リハビリテーション療法(音響療法)を行った患者に片耳から音を聞かせた時の脳活動を調べました。聴力低下の無い健常者では対側の脳の神経活動がやや大きいのですが(左右差=約0.2)、突発性難聴発症時には脳神経活動にあまり左右差を認めませんでした。しかしながら、ステロイド+音響療法を行うと発症後約3ヶ月で、聴力低下の無い健常者の脳活動の左右差とほぼ同等になりました。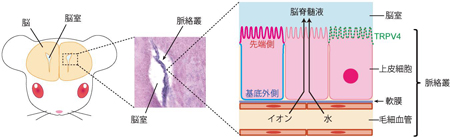 3つある脳室(側脳室、第3脳室、第4脳室)のすべての領域において脈絡叢(濃い紫の部分)は存在しています。脈絡叢は上皮細胞、軟膜、毛細血管から成る一層構造でTRPV4は上皮細胞の先端側に多く存在しています。上皮細胞ではトランスポーターやイオンチャネルにより絶えずイオンが血管側から脳室側へと輸送されているため、それに伴う水の移動が起こり、結果として脳脊髄液が脈絡叢から分泌されています。
3つある脳室(側脳室、第3脳室、第4脳室)のすべての領域において脈絡叢(濃い紫の部分)は存在しています。脈絡叢は上皮細胞、軟膜、毛細血管から成る一層構造でTRPV4は上皮細胞の先端側に多く存在しています。上皮細胞ではトランスポーターやイオンチャネルにより絶えずイオンが血管側から脳室側へと輸送されているため、それに伴う水の移動が起こり、結果として脳脊髄液が脈絡叢から分泌されています。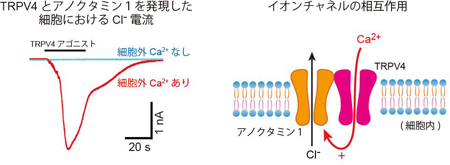 TRPV4とアノクタミン1を共発現している細胞においてホールセルパッチクランプ法により観察されたクロライド電流。共発現細胞では、TRPV4アゴニストによって大きな電流が観察されます(左)。また、この電流は細胞外カルシウムを除去した状態では観察されないことから、TRPV4活性によるカルシウムの細胞内への流入がアノクタミン1を活性化させることが示されました(右)。
TRPV4とアノクタミン1を共発現している細胞においてホールセルパッチクランプ法により観察されたクロライド電流。共発現細胞では、TRPV4アゴニストによって大きな電流が観察されます(左)。また、この電流は細胞外カルシウムを除去した状態では観察されないことから、TRPV4活性によるカルシウムの細胞内への流入がアノクタミン1を活性化させることが示されました(右)。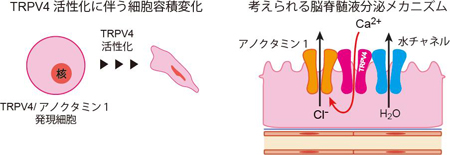 TRPV4とアノクタミン1を発現した細胞においてTRPV4活性化に伴い観察される細胞収縮のモデル図(左)。脈絡叢上皮細胞においてTRPV4が活性化するとTRPV4-アノクタミン1相互作用によりクロライドが流出し、TRPV4と結合する水チャネルを介して水流出も促進されると考えられます(右)。
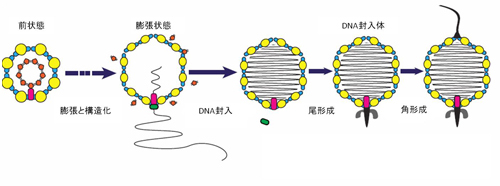
TRPV4とアノクタミン1を発現した細胞においてTRPV4活性化に伴い観察される細胞収縮のモデル図(左)。脈絡叢上皮細胞においてTRPV4が活性化するとTRPV4-アノクタミン1相互作用によりクロライドが流出し、TRPV4と結合する水チャネルを介して水流出も促進されると考えられます(右)。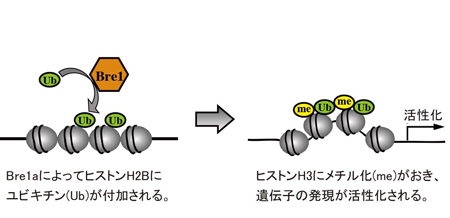 Bre1aは、DNAが巻き付いているヒストンと呼ばれるタンパク質の1つ、H2Bにユビキチンと呼ばれるタンパク質を付加します。その反応が引き金になり、隣のヒストンH3がメチル化され、近傍の遺伝子の発現が活性化されます。
Bre1aは、DNAが巻き付いているヒストンと呼ばれるタンパク質の1つ、H2Bにユビキチンと呼ばれるタンパク質を付加します。その反応が引き金になり、隣のヒストンH3がメチル化され、近傍の遺伝子の発現が活性化されます。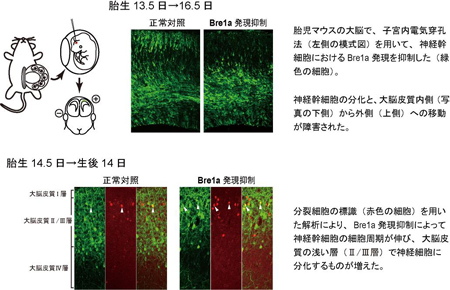

 解説
解説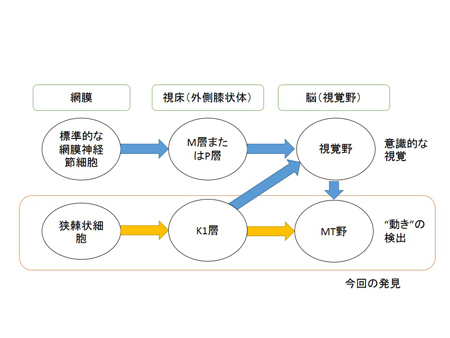
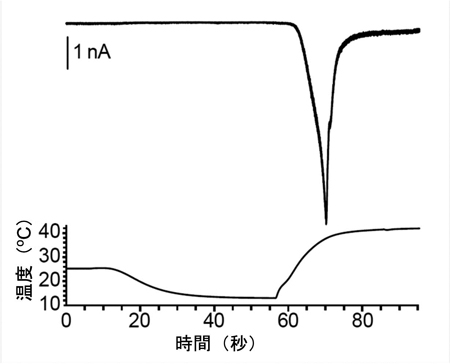
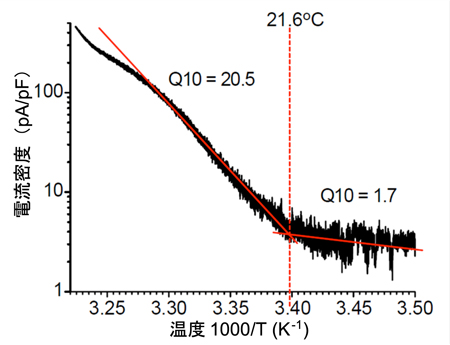 B. 熱応答電流のアレニウスプロット
B. 熱応答電流のアレニウスプロット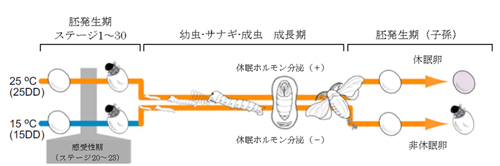 C. 胚発生期温度と休眠卵・非休眠卵表現型決定機構
C. 胚発生期温度と休眠卵・非休眠卵表現型決定機構